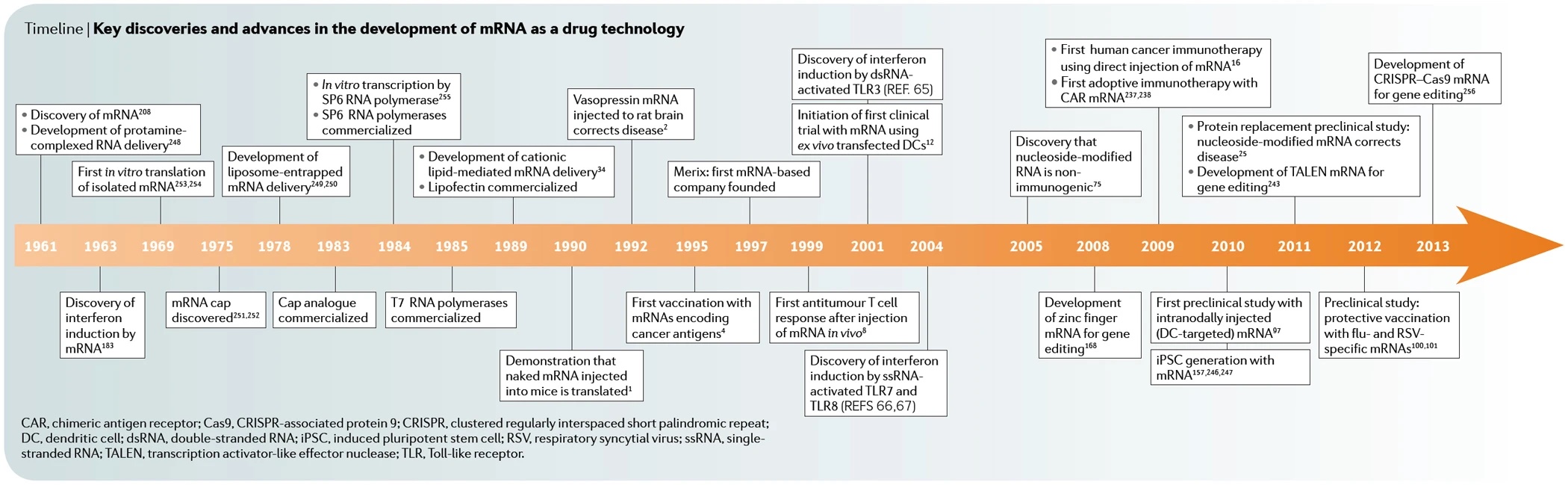
Teil 2 der Serie zur Geschichte der mRNA (Impfstoffe) befasste sich mit dem Kopf-an-Kopf-Rennen im Jahr 1961 sowie mit den Geschehnissen in den 1990er Jahren. Die ersten zwanzig Jahre des neuen Milleniums legten dann ab 2000 einen weiteren Grundstein für die heutigen Anwendungen der mRNA-Technologie als Impfstoff.
Ingmar Hoerr mit seinem Unternehmen CureVac
Die Grundsteinlegung begann im August 2000 mit der Publikation des Forschers Ingmar Hoerr, der synthetisch hergestellte, stabilisierte und geschützte mRNA (verpackt und unverpackt) nutzte, um in-vivo in Mäusen eine spezifische Immun-Antwort zu provozieren. Gleichzeitig gründete er das weltweit zweite mRNA-Unternehmen, die Tübinger CureVac.

Hoerr beschäftigte sich seit 1996 im Rahmen seiner Doktorarbeit an der Universität Tübingen mit dem Thema RNA als möglichen Impfstoff. Zusammen mit Günther Jung, Hans-Georg Rammensee und Reinhard Obst reichte er 1999 eine europäische Patent-Anmeldung ein, die 2001 publiziert und 2005 erteilt wurde. Der Titel: "Transfer von mRNA unter Verwendung von polykationischen Verbindungen". In dieser beschrieben die Anmelder bereits die Anwendung von mRNA als Impfstoff.
Weitere Patent-Anmeldungen erfolgten zusammen mit Kollegen der neu gegründeten CureVac, u.a. Florian von der Mülbe und Steve Pascolo. Nachfolgend findet sich eine Auswahl (in Klammern Jahr 20x der Anmeldung | Erteilung):


Darstellung von der Webseite CureVac
- Verfahren zur Herstellung einer mRNA-Tumorantigen-Bibliothek (02|08)
- Stabilisierte mRNA mit erhöhtem G/C-Gehalt und optimierter codon usage für die Gentherapie (02|10),
- Stabilisierte mRNA mit erhöhtem G/C-Gehalt, kodierend für ein virales Antigen sowie deren Verwendung (02|10) - im Dez 2023 vom Bundespatentgericht für nichtig erklärt
- Transfektion von Blutzellen mit mRNA zur Immunstimulation und Gentherapie (04|08)
- RNA-kodierter Antikörper (08|16) - es ist auch möglich, mRNA zu verabreichen, die für ein "eigenes Antikörper-Medikament" kodiert
- Zusammensetzung zur Behandlung von Prostatakrebs (08|17)
- RNA-Zusammensetzung zur Behandlung von nicht-kleinzelligem Lungenkrebs (08|21)
Ingmar Hoerr und andere Kollegen von CureVac veröffentlichten ab der zweiten Hälfte des ersten Jahrzehnts des neuen Milleniums als Erste Ergebnisse zur Anwendung der mRNA-Technologie bei Krebs- und Infektions-Krankheiten. So 2005 erste Ergebnisse zu ihren Versuchen, tumorspezifische mRNA bzw. davon abgeleitete Moleküle zur Bekämpfung von metastatischem Hautkrebs zu nutzen. In einer in 2003 initiierten klinischen Phase I/II-Studie wurden Patienten mit ihrer eigenen Tumor-mRNA "geimpft": Das Immunsystem sollte so "scharf gemacht werden", um den Tumor wieder besser zu erkennen und ihn damit zu bekämpfen.

Anfangs ist das Immunsystem noch in der Lage, Krebszellen zu eliminieren. Irgendwann wird aber der Punkt erreicht, an dem der Tumor die Kontrolle übernimmt. CureVac's mRNA-Ansatz als Anti-Tumor-Impfstoff war damit der Erste im Feld der Krebs-Immuntherapie.
In 2009 folgte die Veröffentlichung von Resultaten einer weiteren klinischen Phase I/II-Studie mit Patienten, die ebenfalls an metastatischem Hautkrebs litten. mRNA, die für bestimmte Antigene kodierte, wurde direkt injiziert und erzielte bei einem Patienten einen kompletten Rückgang an Krebszellen.


In 2012 schließlich gaben in einer gemeinsamen Publikation das Institut für Immunologie am Tübinger Friedrich-Loeffler-Institut sowie CureVac bekannt, dass mRNA-Impfstoffe in Mäusen eine schützende Wirkung gegen Influenza A Viren (echte Grippe-Viren) aufbauten.
Damit zeigte sich CureVac an der Front bei der Entwicklung von mRNA-Impfstoffen gegen Infektions-Krankheiten.
Katalin Karikó und Drew Weissman von der UPenn
Ebenfalls im Jahr 2000, im Oktober, veröffentlichten die US-Wissenschaftler Drew Weissman und Katalin Karikó von der Universität Pennsylvania (UPenn) zusammen mit weiteren Kollegen eine Abhandlung zur erfolgreichen Induzierung einer in-vitro Immunantwort mittels mRNA transfizierter dendritischer Zellen. Die Versuche gelangen an Zellkulturen in Petri-Schalen, aber zu dem Zeitpunkt noch nicht in vivo, das heißt zum Beispiel an lebenden Mäusen. Diese wurden krank, ihr Immun-System reagierte mit Entzündung auf die "fremde" mRNA.
Sie arbeiteten weiter an ihrer Technologie und konnten mithilfe des Austausches eines Basen-Bausteines beider mRNA deren Immunogenität senken, was sie im August 2005 in einem Artikel publizierten sowie in 2006 zum Patent anmeldeten. Sascha Karberg, der eine Biographie zu Ingmar Hoerr schrieb, fasst die Untersuchungen wie folgt zusammen: "... welche 'Wächter'-Proteine es sind, die fremde RNA erkennen und die Notreaktion der Zellen auslösen, und mit welchen Tricks es etwa Viren wie Influenza, die RNA als Erbgutmolekül verwenden, schaffen, von ihnen unerkannt zu bleiben. Die beiden Wissenschaftler beobachteten, dass die Viren ihre mRNA modifizieren, eine Art Tarnumhang anlegen, indem sie chemische Anhängsel (etwa Methyl-Gruppen) an die RNA-Bausteine A, C, G oder U hängen. Diese Spur verfolgend gelang ihnen 2005 schließlich der Durchbruch: Wenn sie den Uridin-Baustein der mRNA gegen einen künstlichen, in der Natur nicht vorkommenden Pseudouridin-Baustein austauschten, dann entging die mRNA der Aufmerksamkeit der Wächter-Proteine, wurde aber dennoch effektiv in Protein übersetzt."






Stephen Buranyi schreibt in seinem Artikel, dass sich Karikó seit 1989 mit mRNA beschäftigte. Recherchen in PubMed.gov ergeben, dass ihre erste Ko-Veröffentlichung, in deren Titel der Begriff mRNA fällt, 1990 erschien. In dieser sowie in weiteren Publikationen lag der Schwerpunkt jedoch weniger auf der Untersuchung der Nutzung der mRNA als Impfstoff. Eher ging es um eine Optimierung der Methode des Gen-Transfers (zum Beispiel Artikel aus 1998) sowie darum, Zellen zu instruieren, bestimmte Proteine zu bilden (Artikel aus 1999).
Dann geschah etwas, das die wissenschaftliche Forschung oftmals weiter bringt: die Zusammenkunft oder der Austausch mit Kollegen. Schon das Treffen an der Universität Cambridge im April 1960 führte Brenner und Jacob zusammen (siehe Teil 1 der Blog-Serie) und verhalf damit, das mysteriöse Molekül "X" als mRNA aufzuklären. In den späten 1990er war es ein zufälliges Aufeinandertreffen, das die Forscher an der UPenn in Sachen mRNA als Medikament bzw. Impfstoff weiter brachte.
1998 passiert am von zwei Laboren gemeinsam genutzten Photokopierer, war die aufkommende Konversation laut Gina Kolata wie folgt: "Dr. Weissman happened by, and she {Kariko} struck up a conversation. 'I said, ‘I am an RNA scientist — I can make anything with mRNA,’' Dr. Kariko recalled. Dr. Weissman told her he wanted to make a vaccine against H.I.V. 'I said, ‘Yeah, yeah, I can do it,’' Dr. Kariko said." Weissman war seit 1997 an der UPenn und kam vom Labor für Immunregulation des National Institutes of Allergy and Infectious Diseases (Einrichtung des National Institutes of Health, NIH) wo er zusammen mit Anthony Fauci an HIV/AIDS forschte.
Der endgültige Weg zur Medikamenten-Technologie
Mit den Veröffentlichungen aus dem Jahr 2000 startete ein neues Kopf-an-Kopf-Rennen, wie die kurzlebige mRNA stabilisiert und weniger immunogen gemacht werden kann. Ziel war jeweils die mRNA als Medikamenten-Technologie zu nutzen: Reprogrammierung von Zellen, Gen-Therapien, Protein-Ersatztherapien, Stummschalten von Genen, Krebs-Immuntherapien oder Virus-Impfstoffe. Folgende ausgewählte weitere Meilensteine wurden erreicht (nur Erstautor genannt):
- 2002 | Erste klinische US-Studie (Duke University) mit dendritischen Zellen, ex vivo mit mRNA transfiziert, die für PSA (Prostata spezifisches Antigen) kodiert zur Behandlung von Prostata-Krebs. Mit an Bord Eli Galboa, Gründer von Merix Bioscience | A. Heiser
- 2004 | Stabilisierte mRNA-Moleküle haben immunstimulierende Kapazitäten | B. Scheel (CureVac)
- 2006 | Modifizieren von antigen-kodierender RNA erhöht Stabilität, Translations-Effizienz und immun-stimulierende Kapazität dendritischer Zellen | S. Holtkamp (Uni Mainz, Ko-Autoren Sahin & Türeci)
- 2008 | Pseudouridin in mRNA erhöht Translation und biologische Stabilität bei gleichzeitig reduzierter Immunogenität | K. Karikó
- 2009 | Erste adoptive Immun-Therapie mithilfe von mRNA angepassten Rezeptoren von Immun-System-Zellen | S. Yoon
- 2010 | Reprogrammierung von Stammzellen mithilfe synthetisch modifizierter mRNA | L. Warren
- 2011 | HPLC Aufreinigung eliminiert Immun-Aktivierung und erhöht die Translation nukleosid-modifizierter mRNA | K. Karikó
- 2011 | Präklinische Studie zum Protein-Ersatz: Nucleosid-modifizierte mRNA führt zur Bildung von Erythropoietin (EPO); mögliche Alternative zur DNA-basierten Gentherapie | K. Karikó
- 2013 | Erste mRNA Konferenz in Tübingen, ins Leben gerufen von CureVac
- 2015 | Erste klinische Studie zur mRNA Vakzinierung bei Prostata-Krebs | H. Kübler (CureVac)
- 2017 | Veröffentlichungen und Patent-Einreichungen zu mRNA-Impfstoffen gegen HI-, Zika-, Hepatitis C- und Herpes-Viren
- 2017 | Erstes personalisiertes mRNA-Vakzin getestet in Patienten mit Hautkrebs | U. Sahin (BioNTech)
- 2017 | Eliminierung von großen Tumoren in Mäusen über mRNA-kodierte bispezifische Antikörper | C. Stadler (BioNTech)
- 2019 | Studie zur mRNA-basierten Krebs-Immuntherapie bei Patienten mit nichtkleinzelligem Lungenkrebs | M. Sebastian (CureVac)
Als Firmen tauchten neben CureVac die 2008 und 2010 gegründeten BioNTech aus Mainz und ModeRNA aus Cambridge (USA) auf.
Teil 4 dieser Blog-Serie wird weiter auf diese Firmen eingehen sowie ihren Beitrag zur Entwicklung der mRNA-Impfstoffe beleuchten.
Verwendete Quellen:
- Chiranjib Chakraborty et al., Adamas University in Indien, frontiers in Immunology (Jul 2021)
- Sascha Karberg, "Der Mann, der das Impfen neu erfand", Aufbau Verlag (Jun 2021)
- Stephen Buranyi, WIRED, publiziert unter "LONG READS" (Juni 2021)
- Gina Kolata, NY Times (Apr 2021)
- Ugur Sahin, Katalin Karikó und Özlem Türeci, BioNTech SE , Nature (Sep 2014); Bildquelle Titelbild
- Ingmar Hoerr, Gründer von CureVac, in FierceBiotech (Jul 2013)